(中国苏州,2018年10月22日)基石药业(苏州)有限公司(以下简称“基石药业”)今日宣布,2018年欧洲肿瘤医学协会会议(ESMO)期间,基石药业自主研发的首个全人源、自然全长的PD-L1单克隆抗体药物CS1001的I期临床试验初步数据以壁报形式公布。

基石药业董事长兼首席执行官江宁军博士表示:“很高兴基石药业能带着最新的临床数据出席ESMO,让更多同行听到来自中国的声音。CS1001是公司的重要产品之一,希望它能继续表现优秀,有一日代表中国免疫肿瘤药物的创新水平。
I期临床试验的初步数据显示,CS1001在多个瘤种中显示出疗效。目前CS1001的多项临床试验都正顺利开展,上个月末又获得了美国新药临床试验申请批准。我们充分相信其潜力,并将继续推进它的全球开发,早日造福患者。“基石药业首席医学官杨建新博士表示。
CS1001是基石药业开发的中国首个自然全长、全人源抗PD-L1单克隆抗体。本次即将在美国开展的临床试验是一项I期剂量递增的桥接临床研究,目的是在美国实体瘤患者中确定CS1001的II期临床推荐剂量(RP2D)。
试验设计
首次人体试验是在中国进行的Ia / Ib期多中心、开放性的剂量递增和扩增试验,旨在评估CS1001治疗晚期实体瘤或淋巴瘤患者的安全性、耐受性,药代动力学数据和抗肿瘤活性。该试验包括用于确定的II期推荐剂量(RP2D)的Ia期剂量递增阶段,以及用于评估肿瘤特异性群组中的抗肿瘤活性和安全性的Ib期剂量扩增阶段。
ESMO上公布的初步数据
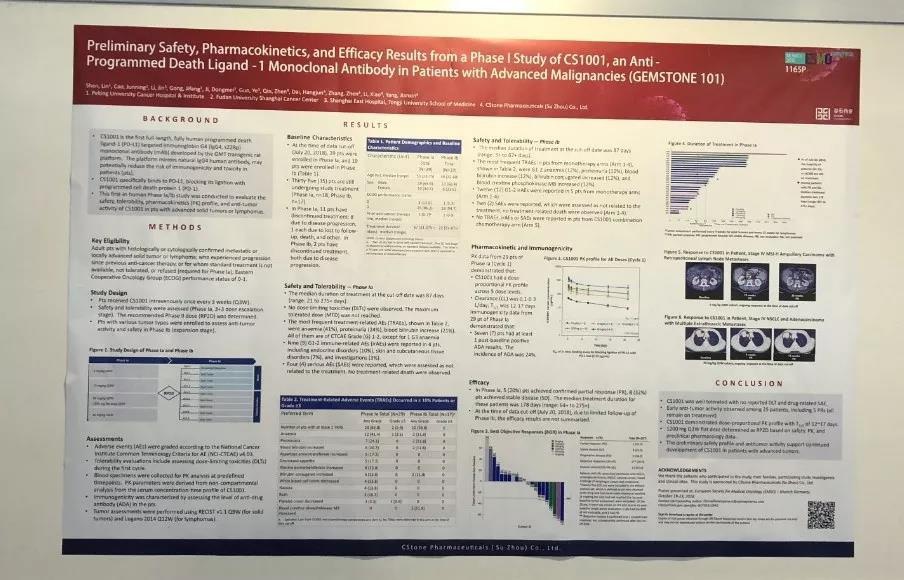
数据截止2018年7月20日,总计入组48名患者。
Ia期研究中共有29名患者通过五个剂量递增组进行每三周一次(Q3W)静脉注射治疗,剂量范围为3到40mg/kg,没有观察到剂量限制性毒性(DLT),并且未达到最大耐受剂量(MTD),整体耐受良好。
基于安全性,PK和临床前药理学数据,Ib期已有19名患者接受每三周一次1200 mg固定剂量的RP2D治疗,未出现3级治疗相关不良反应,未出现与治疗相关死亡。Ib期患者入组仍在进行中。
疗效分析在Ia期的25名患者中进行。5名患者(20%)达到确认的部分缓解(PR),8名患者(32%)获得疾病稳定(SD)。 这些患者的中位治疗持续时间为178天。
关于CS1001
CS1001是由基石药业开发的在研抗PD-L1单克隆抗体。CS1001由美国Ligand公司授权引进的OMT转基因动物平台产生,该平台可实现全人源抗体的一站式生产。作为一种全人源全长的抗PD-L1单克隆抗体,CS1001是一种最接近人体自身天然G型免疫球蛋白4(IgG4)的单抗药物。它可降低在患者体内产生免疫原性及相关毒性的风险,与同类药物相比具有潜在的独特优势。
目前,CS1001已在中国完成I期临床研究剂量爬坡,在Ia期研究中,CS1001呈现出良好的耐受性和持续的临床获益。此外,另有两项关键II期研究正在中国开展,分别为:自然杀伤细胞/T细胞淋巴瘤(CS1001-201)及经典型霍奇金淋巴瘤(CS1001-202),并已开始或准备在中国/全球开展的多项严重癌症适应症的III期研究
关于基石药业
基石药业是一家为满足患者需求而生,专注于肿瘤创新药物及肿瘤免疫联合疗法开发的中国创新生物制药企业。成立于2015年底,基石药业凝聚了世界级的顶尖管理团队,并成功构建起一支具有国际水平、以临床研发及转化医学为核心竞争力的团队。在业务模式方面,基石药业采取自主研发兼临床驱动与商务拓展结合的方式,目前公司已构建起中国最大规模的抗肿瘤药研发管线之一,拥有14种抗肿瘤药物,同时拥有自主研发产品与国际合作产品,已与Blueprint Medicine和Agios制药两家公司达成独家合作与授权协议。基石的业务模式受到投资者的广泛认可,A轮与B轮融资额皆打破当时生物医药领域记录,两轮融资额共计4.1亿美元。致力于成为国内领先、享誉全球的生物制药企业,基石药业将成为患者通往健康明天的基石。
欲了解更多,请浏览www.cstonepharma.com