(中国苏州,2020年9月25日)2020年9月19日-9月21日,在欧洲肿瘤内科学会(ESMO)2020年学术年会上,基石药业(苏州)有限公司(以下简称“基石药业”,香港联交所代码:2616)公布了两项CS1003的研究数据,分别为CS1003在晚期肿瘤患者的药代动力学特征、安全性、及初步抗肿瘤活性研究(CS1003-101 1b研究, Poster ID: 1057P)和PD-1阻断剂CS1003 联合仑伐替尼(lenvatinib,LEN)用于一线治疗(1L)不可切除肝细胞癌(uHCC)中国患者的Ib期临床研究(CS1003-102 1b研究, Poster ID: 987P)。在这两项临床研究中,抗PD-1单抗CS1003不论单药还是联合标准治疗中,均显示了良好的安全性与有效性, 支持其作为骨架免疫肿瘤制剂继续开展未来的临床研究。
CS1003是基石药业通过领先的杂交瘤技术平台开发的一种针对PD-1的全长、人源化免疫球蛋白G4 (IgG4) 单克隆抗体,该药在临床前体内试验中已表现出了良好的耐受性和有效性。不同于其它PD-1抗体,基石药业开发的CS1003抗体可以同时识别人源和鼠源的PD-1,在多种同源小鼠肿瘤模型的有效性测试以及联合用药的开发中具有独特优势,包括本文所述的与仑伐替尼联用。
CS1003-101研究(NCT03475251)
CS1003-101研究Ib期部分是一项探索CS1003在两种给药方案200毫克Q3W和400毫克Q6W下的有效性、安全性、药代动力学研究。主要研究终点是研究者基于RECIST V1.1评估的客观缓解率,次要研究终点是为评估无进展生存期(PFS)、疾病控制率(DCR)、疗效持续时间(DOR)和总生存期(OS)、并评估药物的安全性及耐受性、药代动力学和免疫原性。
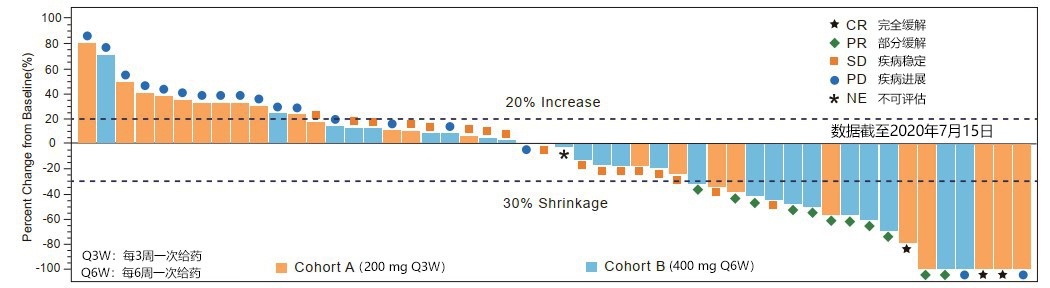
CS1003在晚期实体瘤患者人群中,200 mg Q3W和400 mg Q6W这两种给药方案具有相近的稳态时平均血浆药物浓度 (Cavg,ss),客观缓解率都在20%以上且不良反应轻微,安全性和有效性兼备。
按照RECIST v1.1评估的靶病灶最大缩小的瀑布图(有效性分析集)
CS1003-102研究(NCT03809767)
CS1003-102研究是一项在中国开展的多中心、开放性的剂量递增和适应症扩展的I期研究,此研究Ib期部分第五组旨在评估CS1003 联合仑伐替尼(lenvatinib, LEN)一线治疗在中国不可切除肝细胞癌(uHCC)患者中安全性和有效性。主要研究终点为研究者基于RECIST V1.1评估的客观缓解率(ORR),次要研究终点为评估无进展生存期(PFS)、疾病控制率(DCR)、疗效持续时间(DOR)和总生存期(OS)、并评估药物的安全性及耐受性、药代动力学和免疫原性。
截至2020年6月22日,共计20例患者入组并接受治疗。入组患者多数患者为男性(90%),ECOG状态评分为1分(75%),BCLC C期HCC(90%),65% 伴有HBV感染。
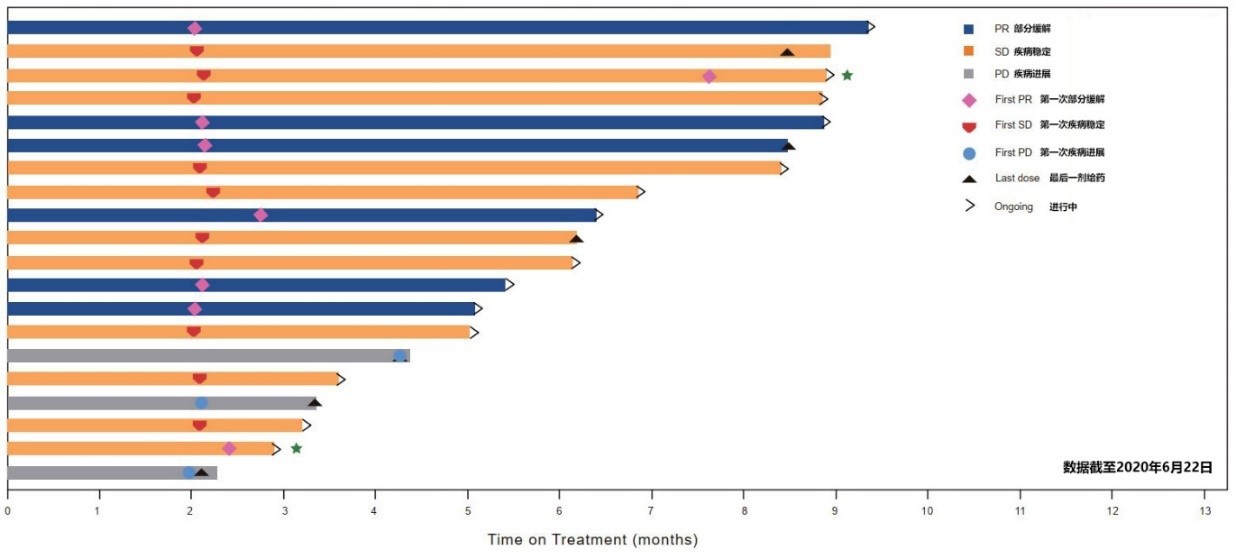
CS1003 联合仑伐替尼(lenvatinib,LEN)治疗一线(1L)不可切除肝细胞癌(uHCC)中国患者显示出可达40%的缓解率,并且安全性良好:
治疗时间、个体最佳疗效(疗效分析集)
基石药业首席转化医学官谢毅钊博士表示:“我们很高兴看到抗PD-1单抗CS1003不论是单药治疗还是联合标准治疗在有效性、安全性方面都有优异的表现。CS1003是一款高亲和力且能强效阻断PD-1与其配体结合的单克隆抗体。CS1003在晚期实体瘤患者人群中,表现出良好的安全性和有效性,400mg Q6W给药方案为患者进行更为灵活和便捷的用药提供了新的选择。此外,CS1003作为一种具有独特机制的新型PD-1与仑伐替尼联合使用确认ORR可以达到40%,对于晚期非可切除肝癌来说有着非常巨大的临床优势。未来我们将在临床试验中继续挖掘CS1003在肿瘤治疗领域的更多潜能。”
关于CS1003
CS1003是一种靶向人程序性细胞死亡蛋白1(PD-1)的人源化重组IgG4单克隆抗体,正在开发用于多种肿瘤的免疫治疗。与已经获批或正在临床试验的大多数结合人源及猴PD-1的单克隆抗体相比,CS1003与人类、食蟹猴和小鼠PD-1均具有高亲和力,可阻断PD-1与PD-L1和PD-L2配体的相互作用。它的具有同时识别人和鼠PD-1的差异化特性,将大大加速在同源肿瘤模型中进行CS1003与全新靶点药物联用的临床前概念验证。
关于基石药业
基石药业(HKEX: 2616)是一家生物制药公司,专注于开发及商业化创新肿瘤免疫治疗及精准治疗药物,以满足中国和全球癌症患者的殷切医疗需求。成立于2015年底,基石药业已集结了一支在新药研发、临床试验以及商业化方面拥有丰富经验的世界级管理团队。公司以肿瘤免疫治疗联合疗法为核心,建立了一条15种肿瘤候选药物组成的丰富产品管线。目前5款后期候选药物正处于关键性临床试验。凭借经验丰富的管理团队、丰富的管线、专注于临床开发的业务模式和充裕资金,基石药业的愿景是通过为全球癌症患者带来创新肿瘤疗法,成为全球知名的中国领先生物制药公司。
前瞻性声明
本文所作出的前瞻性陈述仅与本文作出该陈述当日的事件或资料有关。除法律规定外,于作出前瞻性陈述当日之后,无论是否出现新资料、未来事件或其他情况,我们并无责任更新或公开修改任何前瞻性陈述及预料之外的事件。请细阅本文,并理解我们的实际未来业绩或表现可能与预期有重大差异。本文内所有陈述乃本文章刊发日期作出,可能因未来发展而出现变动。